Не вызывает сомнений, что CO2 существует в каждой природной воде в большей или меньшей концентрации. Двуокись углерода обладает очень хорошей растворимостью, которая ограничивается обменом с атмосферой. Растворенный CO2 переходит в угольную кислоту (H2CO3) в незначительном количестве (примерно 0,1-0,2%).
CO2+ H2O => H2CO3.
Даже если этот процесс выражен слабо, образование кислоты неизбежно приводит к снижению pH. Воды, обогащенные угольной кислотой, могут достигать значений pH около 5, а иногда бывают и ниже. При растворении двуокиси углерода в воде возрастает проводимость. Это происходит из-за образования ионов:
H2CO3+ H2O => H3O+ + HCO3–,
появляются ион гидроксония и гидрокарбонат-ион. Гидрокарбонат-ион вступает в соединения со щелочноземельными металлами, из которых самым важным является Ca(HCO3)2 (соль угольной кислоты) и существует в воде полностью диссоциированным, т.е. в виде катионов и анионов.
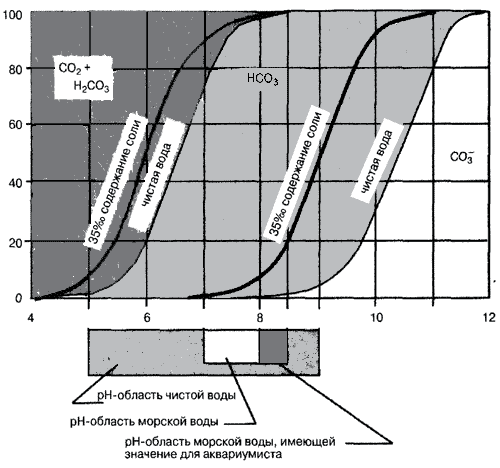
Соотношение углекислого газа и анионов угольной кислоты в воде в зависимости от pH (кривые для морской и пресной воды)
Гидрокарбонат кальция хорошо растворяется в воде. Именно это соединение образует временную жесткость. Гидрокарбонат содержит химически связанный CO2, который называется в соответствии с этим «связанной угольной кислотой». Количество гидрокарбоната кальция в водном растворе не изменяется, если имеется дополнительный CO2, или равновесный CO2, свободная углекислота.
Если такое же количество свободного CO2, как и Ca(HCO3)2 имеется в наличии, то вода находится в так называемом равновесии кальций – угольная кислота. Часто встречается вода, в которой растворено больше свободного CO2, чем это необходимо для поддержания равновесия «кальций – угольная кислота». Раствор в этом случае называется «свободной перенасыщенной кислотой». Эта угольная кислота химически активна, но для реакции необходимы соответствующие соединения.
Таким образом, к примеру, растворяется известняк (CaCO3), в результате чего снова повышается содержание гидрокарбоната кальция, и вода стремится к равновесию кальций – угольная кислота. Свободная избыточная угольная кислота растворяет пассивные слои в трубопроводах из металлов, разрушает также трубопроводы из меди и свинца, вследствие чего, с одной стороны, повреждаются водные коммуникации, с другой стороны, вода может обогащаться токсичными соединениями металлов. Если в воде недостаточно высокая концентрация свободной углекислоты, в осадок выпадает карбонат кальция (CaCO3). Нам он известен как известняк, который практически нерастворим в воде.
Превращения между гидрокарбонатом и карбонатом кальция выражаются следующим уравнением:
CO2 недостаток (стрелка вправо)
Ca(HCO3)2 <=> CaCO3+ CO2+ H2O
CO2 избыток (стрелка влево)
Оно отчетливо показывает, что переход от одного вида связи в другой всегда сопровождается также изменениями pH, Если при недостатке CO2 выпадает известняк, то должно повышаться значение pH. И наоборот, при избытке CO2 значение pH снижается. Различные виды связей CO2, с которыми мы здесь познакомились, таковы:
двуокись углерода = CO2;
угольная кислота = H2CO3;
гидрокарбонат = HCO3–, чаще в виде Ca(HCO3)2 и называется также бикарбонатом;
карбонат = CO32–, чаще всего в виде CaCO3
Эти формы частично могут существовать совместно в воде. От значения pH зависит, какая из них преобладает. В мягкой кислой воде с pH 6 примерно 80% двуокиси углерода будет присутствовать в виде CO2 или в виде угольной кислоты и только примерно 20% в виде гидрокарбоната.
При pH 7 соотношение становится другим – преобладает HCO3. При pH 8 – 9 HCO3– составляет свыше 90%, а HCO3 и карбонаты, например CaCO3 незначительно. В морской воде наблюдаются совсем другие закономерности. Граница между углекислотой и гидрокарбонатом только немного смешена влево, но значительно более сильное изменение отмечается между гидрокарбонатом и карбонатом. Это приводит к тому, что в оптимальной для аквариумов с морской водой pH-области (pH 8 – 8,5) практически не существует свободной угольной кислоты, но присутствует большое количество карбонатов.
Это для морских живых существ особенно важно. Кальциефильные организмы, прежде всего коралловые, находят в море оптимальные условия (достаточное количество извести). В частности, приповерхностная вода, которая смешивается с атмосферой, пересыщена карбонатом кальция, причем тем больше, чем больше температура воды. Чем холоднее вода, тем больше она может поглощать CO2. Поэтому диатомные организмы холодных морей образуют оболочки тела из кремниевой кислоты. Растворимость CO2 возрастает также с увеличением глубины, Вследствие этого в воде уменьшается количество карбонатов, поэтому столь популярные для аквариумов коралловые рифы расположены только в теплых поверхностных водах тропиков.
