Благодаря растениям в аквариуме при наличии света в процессе фотосинтеза происходит усвоение углекислоты и выделение кислорода. Наилучшие условия для усвоения углекислоты бывают утром и к концу дня: в это время в солнечном свете преобладают красные лучи. Растения поглощают неорганические и органические вещества, появляющиеся в воде вследствие жизнедеятельности рыб и разложения остатков пищи, отмерших улиток, листьев растений, и тем самым улучшают воду и служат хорошим стабилизатором ее качества. Бурно развивающиеся высшие растения препятствуют размножению низших растений, которые не желательны в аквариуме.
Для некоторых видов рыб растения являются источником пищи. Для большинства из них – служат местом отдыха, для мальков и менее агрессивных рыб – убежищем. Для икромечущих рыб растения в аквариуме служат материалом для постройки гнезда, являются нерестовой средой. Высокорастущие и плавающие растения для аквариумов, установленных в светлых помещениях, служат естественной ширмой от яркого света. Растения для аквариумов имеют большое эстетическое значение, особенно при правильном художественном оформлении.
Вода
Содержание и размножение аквариумных растений возможно только в определенных условиях. Одним из таких условий является определенное качество воды – среды, в которой произрастают растения. В природе вода по своим химическим и физическим свойствам очень разнообразна. Качество воды зависит от географического расположения водоема, состава грунта, количества выпадающих осадков, а также от обитателей водоема. Следовательно, состав воды небезразличен для нормальной жизнедеятельности растений и допустимые изменения его в аквариуме должны находиться в пределах близких к естественным условиям.
Химические свойства воды
Жесткость. В природной воде всегда присутствуют соли. От содержания в воде растворенных солей кальция и магния зависит ее жесткость. Если солей много, то вода называется жесткой, если очень мало – мягкой. Различают жесткость воды временную, постоянную и общую. Временная жесткость воды зависит от содержания в ней бикарбоната кальция Са(НСО3)2 и бикарбоната магния Mg(HCO3)2. Простым кипячением эти соли разрушаются, выпадают в осадок и жесткость воды значительно понижается, например Са(НСО3)2 = Ca-СО3 + Н2О + CO2-. Этот осадок мы можем видеть на дне и стенках чайника, в котором часто кипятим воду.
Если же вода содержит сульфаты и хлориды кальция и магния, то жесткость ее называется постоянной и может быть устранена только дистилляцией или химическим путем.
Общая жесткость воды равна сумме временной и постоянной жесткости. В СССР жесткость воды выражают суммой миллиграмм-эквивалентов ионов кальция и магния, содержащихся в 1 л воды. 1 мг-экв жесткости отвечает содержанию 20,04 мг/л Са или 12,16 мг/л Mg.
В других странах жесткость воды измеряется в градусах жесткости:
- немецкие градусы: 1 ° = 1 г СаО в 100000 г воды или 10 мг СаО в 1 л воды;
- английские градусы: 1 гран (0,0648 г) СаСО3 в 1 галлоне (4,546 л) воды = 1 г СаСО3 в 70000 г воды или 10 мг СаСО3 в 0,7 л воды;
- французские градусы: 1 ° = 1 г СаСО3 в 100 000 г воды или 10 мг СаСО3 в 1 л воды;
- американские градусы: 1° = 1г СаСО3 в 10 000 г воды или 1 мг СаСО3 в 1 л воды.
В аквариумной практике наиболее удобно выражать жесткость воды в русских и немецких градусах (Н°= DgH). Сравнение единиц измерения жесткости воды приведено в табл. 1 и2.
| Жесткость, мг = экв/л | русской и немецкой | французской | английской | американской |
|---|---|---|---|---|
| 1 | 2,804 | 5,005 | 3,511 | 50,045 |
| 0,35663 | 1 | 1,7848 | 1,2521 | 17,847 |
| 0,19982 | 0,5603 | 1 | 0,7015 | 10 |
| 0,28483 | 0,7987 | 1,4255 | 1 | 14,253 |
| 0,01998 | 0,0560 | 0,1 | 0,0702 | 1 |
Анализ воды по степени жесткости может быть определен в специальной лаборатории. Лабораторный способ определения содержания кальция и магния в воде наиболее совершенный, так как анализ проводится на современном оборудовании, в надлежащих условиях и специалистами. Воду для анализа необходимо брать со средней глубины аквариума после тщательного перемешивания ее с помощью продува воздухом. Воды для сдачи в лабораторию должно быть не менее 250 мл (обязательно в чистой стеклянной посуде).
| Жесткость, мг = экв/л | Жесткость, выраженная в градусах по шкалам: | ||||
|---|---|---|---|---|---|
| русской | немецкой | французской | английской | американской | |
| Очень мягкая | До 1,5 | До 4,2 | До 7,5 | До 5,27 | До 75,0 |
| Мягкая | 1,5–3 | 4,2–8,4 | 7,5–15,0 | 5,27– 10,53 | 75– 150,1З |
| Умеренно жесткая | 3–6 | 8,4–16,8 | 15–30 | 10,53– 21,0 | 150,13– 300,27 |
| Жесткая | 6–9 | 16,8–25,2 | 30–45 | 21,0–31,6 | 300,27–450,4 |
| Очень жесткая | Свыше 9 | Свыше 25,2 | Свыше 45 | Свыше 31,6 | Свыше 450,4 |
Для определения жесткости воды в домашних условиях необходимо иметь несложное лабораторное оборудование и реактивы.
Лабораторное оборудование (рис. 11): микробюретка – 1 шт.; измерительная градуированная пипетка – 2 шт.; стеклянная колба – 2 шт.; химические стаканы на 100 мл – 2 шт.; мерный цилиндр – 1 шт.
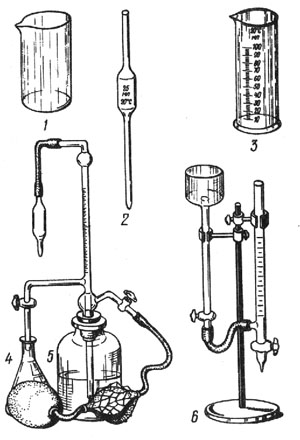
Рис. 11. Лабораторное оборудование: 1 — химический стакан; 2 — измерительная пипетка; 3 — мерный цилиндр; 4 — стеклянная колба; 5, 6 — микробюретки
Реактивы: буферный раствор; сульфид натрия – Na2S; индикаторная жидкость (хромоген черный ЕТ-00); трилон Б.
Ход определения. Перед началом работы всю посуду тщательно моют водопроводной водой, а затем дистиллированной. В две колбы наливают по 100 мл исследуемой воды. В каждую колбу добавляют 5 мл буферного раствора (раствор набирают пипеткой), 1 мл сульфида натрия (Na2S) и 5–6 капель индикаторной жидкости (хромоген черный ЕТ-00). Содержимое в колбах хорошо перемешивают. Полученные растворы имеют марганцово-розовый цвет. Содержимое колб титруют трилоном Б, добавляя в каждую колбу маленькими каплями трилон Б до появления синего окрашивания.
После этого отмечают количество миллилитров трилона Б, израсходованного на титрование на каждую колбу.
Пример. На титрование раствора в первой колбе израсходовано трилона Б 0,43 мл, а во второй колбе 0,41 мл. Определяем среднюю величину израсходованного трилона Б на титрование раствора по формуле:
Vср = (V1 + V2)/2 = (0,43 +0,41)/2 = 0,44/2 = 0,42 мл
Содержание кальция и магния (общую жесткость) вычисляем по формуле:
Ж = (Vср N)/V = 0,42 • 0,1 • 1000 = 0,42 мг-экв/л,
где Vcp – количество трилона Б, пошедшего на титрование, мл; 0,1 – нормальность трилона; 1000 – пересчет на 1 л воды; V – объем исследуемой воды.
Для перевода в градусы жесткости следует полученную цифру умножить на 2,8.
Умягчение воды для аквариума. Умягчение воды может быть достигнуто путем взятия ее из находящегося вблизи естественного водоема, освобождения воды от карбонатной жесткости с помощью кипячения, смешивания воды в определенных пропорциях с дистиллированной или химически обессоленной водой. В сельской местности возможно применение дождевой воды. Наиболее трудоемкий способ получения воды нужной жесткости – это смешивание имеющейся воды с дистиллированной или химически обессоленной водой. Способы получения умягченной воды известны, но так как приходится иметь дело с различными по качеству дистилляторами и ионитами, то результат их работы необходимо тщательно проверить. Обычно вода по степени жесткости характеризуется следующими данными: дистиллированная в Н° =0,8 – 2,3; химически обессоленная в Н°= 0,2 – 0,4; подлежащая обработке в Н° = 6 – 15.
В табл. 3 приведены ориентировочные данные для приготовления воды нужной жесткости.
| Требуемая жесткость в Н° | Количество дистиллированной воды, мл, добавляемой к 1 л водопроводной | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | |
| 3 | 1000 | 1350 | 1650 | 2000 | 2350 | 2680 | 3000 | 3350 | 3670 | 4000 |
| 4 | 500 | 750 | 1000 | 1250 | 1500 | 1750 | 2000 | 2250 | 2500 | 2750 |
| 5 | 220 | 400 | 650 | 800 | 1000 | 1200 | 1400 | 1600 | 1800 | 2000 |
| 6 | – | 170 | 320 | 520 | 660 | 820 | 1000 | 1200 | 1400 | 1600 |
| 7 | – | – | 140 | 220 | 440 | 560 | 700 | 840 | 980 | 1120 |
| 8 | – | – | – | 125 | 250 | 380 | 500 | 650 | 810 | 980 |
Пример. Жесткость водопроводной воды 6; необходимо получить воду с жесткостью 3. По горизонтали в таблице указана жесткость водопроводной воды, по вертикали – требуемая жесткость. В графе, находящейся под цифрой 6, находим данные, соответствующие цифре 3 вертикального столбца. Из таблицы видно, что для получения нужной жесткости к 1 л водопроводной воды следует добавить 1 л дистиллированной.
Таблица дает точные данные в том случае, если мы пользуемся водой с жесткостью 0,4. Жесткость воды можно уменьшить химическим путем, если применить в аквариуме пермутитовые фильтры, содержащие натрий, который бурно вступает в химическую реакцию с растворенными в воде солями кальция. В процессе фильтрации воды пермутит поглощает соли кальция, выделяет натрий, и вода умягчается. Для повышения жесткости воды необходимо грунт брать с большим количеством известняка и мрамора.
Диссоциация воды. Водородный показатель. Одним из наименее диссоциированных веществ, образующихся при реакциях между ионами, является вода. Чистая вода плохо проводит электрический ток, но все же обладает некоторой измеримой электропроводностью, которая объясняется небольшой диссоциацией воды на водородные и гидроксильные ионы:
Н2О -> <- Н+ + ОН—.
Вычисленная по электропроводности концентрация ионов водорода и гидроксила в воде оказалась равна 10-7 г-ион/л при 22° С.
Поскольку электролитическая диссоциация обратима, она подчиняется закону действия масс. Поэтому для процесса диссоциации воды можно написать:
([H+] x [HOH-]) /H2O = K
Преобразуя это уравнение, получим [Н+] x [ОН—] = [Н2О] K. Но степень диссоциации воды очень мала и концентрацию недиссоциированных молекул в ней, а также в любом разбавленном водном растворе можно считать величиной постоянной. Из этого следует считать, что в правой части уравнения находятся две постоянные величины: [Н2О] – концентрация недиссоциированных молекул воды и К – константа диссоциации. Но произведение двух постоянных величин есть также величина постоянная. Поэтому, заменив [Н2О] x K новой константой, получим [Н+] x [ОН—] = КH2O.
Следовательно, как бы ни изменялись концентрации ионов H+ и ОН— в воде или в разбавленном водном растворе, произведение их остается величиной приблизительно постоянной. Эту величину называют ионным произведением воды. Числовое значение этой константы нетрудно найти, подставив в уравнение величины концентраций водородных и гидроксильных ионов в воде: КH2О = [Н+] o [OH-] = 10-7 x 10-7 = 10-14. Реакцию того или иного раствора принято характеризовать только концентрацией водородных ионов, так как концентрацию ионов ОН— легко вычислить, исходя из ионного произведения воды. Допустим, что к чистой воде прибавили кислоты и концентрация ионов Н+ достигла 10-3 г-ион/л. Тогда концентрация ионов ОН— в растворе равна:
[OH-] = KH2O/[H+] = 10-14/10-3 =10-11 г-ион/л.
Наоборот, если прибавить к воде щелочи и тем повысить концентрацию гидроксильных ионов (например, до 10-5), то концентрация водородных ионов станет равна:
.[H+] = 10-14/10-5 = 10-9
Следовательно, как кислотность, так и щелочность раствора можно количественно характеризовать концентрацией водородных ионов.
В нейтральных растворах концентрация ионов водорода равна концентрации гидроксильных ионов. В кислых растворах концентрация ионов H+ больше, а в щелочных – меньше. Нейтральный раствор [Н+] = [ОН—] = 10-7 г-ион/л; кислый раствор [H+]>10-7 г-ион/л; щелочной раствор [Н+] < 10-7 г-ион/л.
Обычно на практике среду раствора характеризуют не самой концентрацией водородных ионов, а так называемым водородным показателем.
Водородный показатель, обозначаемый через рН, представляет собой отрицательный логарифм концентрации водородных ионов: рН =–lg[H+]. Например, если концентрация водородных ионов [Н+] =10-5 г-ион/л, то рН = 5; если [Н+] = 10-9 г-ион/л, то рН = 9 и т. д. Очевидно, что нейтральные растворы имеют рН = 7, в кислых растворах рН < 7, а в щелочных рН > 7.
В аквариумной практике вода, соответствующая рН 2–3, считается сильно окисленной, 3–5 – кислой, 5–6 – слабокислой, 6–7 – очень слабокислой, 7 – нейтральной, 7–8 – очень слабощелочной, 8–9 – слабощелочной, 9–10 – щелочной, 10–14 – сильно щелочной. Измерение рН в домашних условиях можно рекомендовать простым способом. Его принцип основан на цветной цифровой шкале, точность измерения этого способа до 0,1 ед. Возможно измерение рН с помощью бумажных индикаторов, пропитанных составом из органических красителей, точность измерения до 0,3 ед.
Для кружков, клубов аквариумистов, имеющих специальные лаборатории, где требуются при измерении рН высокие точности и имеет значение экономия времени на измерениях, можно рекомендовать лабораторный многопредельный рН-метр ЛПУ-01 с датчиком ДЛ-01, который предназначен для определения активности ионов водорода в водных растворах. Принцип измерения величины рН с помощью измерителя ЛПУ-01 заключается в следующем.
Для измерения величины рН используется электродная система со стеклянным электродом, электродвижущая сила которого зависит от активности ионов водорода в растворе. Схема такой электродной системы показана на рис. 12. Стеклянный электрод 2 представляет собой трубку с напаянным на конус полым шариком 1 из литиевого электродного стекла. При погружении электрода в раствор между поверхностью шарика и раствором происходит обмен ионами, в результате которого ионы лития в поверхностных слоях стекла замещаются ионами водорода, и стеклянный электрод приобретает свойства водородного электрода. Между поверхностью стекла и контролируемым раствором возникает разность потенциалов Ех, величина которой определяется активностью ионов водорода в растворе:
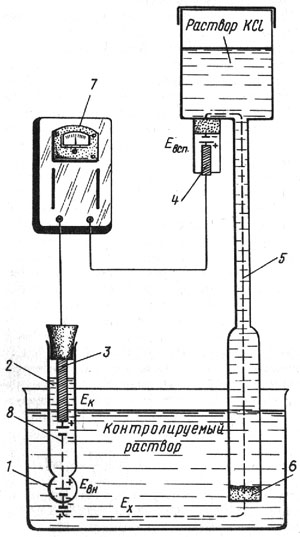
Рис. 12. Схема электродной системы pH-метра ЛПУ-01: 1 — полый шарик из электродного стекла; 2 — раствор, заполняющий внутреннюю полость электрода; 3 — внутренийй контактный электрод; 4 — вспомогательный электрод; 5 — электролитический контакт; 6 — пористая перегородка; 7 — pH-метр ЛПУ-01; 8 — стеклянный электрод
Ех = RT/F x ln aН = 2,3 RT/F x рН,
где R — универсальная газовая постоянная, равная 8,315 x 107 эрг/°С моль;
Т– температура раствора °К;
F – 96 500 кулон/г-экв (число Фарадея);
аН – активность ионов водорода в растворе.
Подготовку к работе рН-метра и измерения активной реакции воды производят согласно прилагаемой к прибору инструкции по эксплуатации.
Воду подкисляют после тщательной промывки аквариума и грунта обычной водопроводной водой. Подкисление осуществляют путем внесения в воду вываренного торфа, ивового корня, ольховых шишек и других кислых веществ. Применение химических кислот не рекомендуется. В аквариуме, простоявшем более года без полной смены воды и без промывки грунта, вода имеет слабокислую или очень слабокислую реакцию. Большинство растений прекрасно произрастают при нейтральной рН или близкой к ней.
Кислород. Важным жизненным условием для водных растений является кислород, который поступает в воду аквариума из атмосферы. Чем больше водная поверхность, тем больше поступает в воду кислорода. Необходимое количество кислорода, растворенного в воде, во многом зависит и от правильного подбора видов и количества водных растений, от создания благоприятных условий для их произрастания. Растение является надежным источником обогащения воды кислородом. Благоприятные условия – это достаточное количество естественного и искусственного света, оптимальная температура, питательная водная среда, чистота растений и правильно приготовленный грунт.
Кислород поглощается водой в большей дозе, чем азот, поэтому растворенный в воде воздух более богат кислородом, чем атмосферный воздух.
Значительно больше кислорода в холодной воде, чем в теплой. Тропические растения потребляют меньше кислорода по сравнению с растениями средней географической полосы. Недостаток в воде кислорода может привести к болезням или гибели растений. Недостаток кислорода в аквариумной воде можно определить по поведению рыб: они висят у поверхности воды.
Недостаток кислорода в аквариуме наблюдается при плохом освещении аквариума в зимнее время или летом в плохую погоду. Лучшей помощью может быть равномерное обогащение воды воздухом с помощью компрессора, в некоторых случаях необходимо частично очистить и удалить гниющие вещества, которые расходуют кислород. Сам процесс смены воды обогащает ее кислородом.
При содержании в аквариуме рыб и растений из проточных водоемов, расположенных в средней географической полосе, необходим сильный продув воды воздухом. Кроме того, освежение нижних слоев воды достигается и естественной ее циркуляцией: у стекла, обращенного к свету, теплая вода, нагреваясь, поднимается.
Углекислый газ. В жизнедеятельности растений углекислый газ играет большую роль. В воде углекислый газ присутствует в свободном состоянии (СО2), в соединении с водой образует угольную кислоту (Н2СО3), в соединении с кальцием дает бикарбонат Са(НСО3)2и карбонат СаСО3. Углекислота в воде образуется за счет дыхания рыб и растений, разложения органических веществ, которое увеличивается с повышением температуры воды. Кроме того, в воде растворяется углекислый газ воздуха. Углерод, содержащийся в углекислоте, прекрасно усваивается растениями и идет на построение тканей. Количество углекислого газа в воде не постоянно и зависит от времени суток: днем уменьшается, в ночное время увеличивается. В зимние месяцы среднесуточное содержание углекислого газа в воде больше, чем в летнее. Его количество зависит и от размера рыб, видов и количества растений, от правильного ухода за аквариумом. В аквариуме, где годами не промывался грунт, может образоваться большое количество сероводорода, который очень ядовит. Присутствие сероводорода в аквариуме определяют по запаху, взяв пробу грунта. О наличии сероводорода свидетельствует резкий, неприятный запах. В таких случаях требуется полная чистка аквариума.
